Notes
हैलोएल्केन का वर्गीकरण :-
(1) हैलोजन परमाणुओ की संख्या के आधार पर :-
हैलोजन परमाणुओ की संख्या के आधार पर हैलोएल्केन को मोनो डाई, ट्राई व पॉली आदि मे वर्गीकृत करते हैं, जिनमे क्रमश: एक, दो, तीन व अधिक हैलोजन परमाणु उपस्थित होते है।
(a) मोनो हैलोएल्केन्स:- इनमे एक हैलोजन परमाणु उपस्थित होते हैं।
- जैसे- CH3 – X, CH3CH2X
- इन्हे मोनो हैलोएल्केन्स या एल्किल हैलाइड [R-X] कहते है।
(b) डाई हैलोएल्केन्स:- इनमें दो हैलोजन परमाणु उपस्थित होते हैं।
ऐल्केन्स से प्राप्त डाई हैलाइड को डाई हैलोऐल्केन्स कहते हैं।
(c) ट्राई हैलोऐल्केन्स:- इनमें तीन हैलोजन परमाणु उपस्थित होते हैं।
ऐल्केन्स से प्राप्त ट्राई हैलाइड को ट्राई हैलोऐल्केन्स कहते हैं।
(2) मोनो हैलोएल्केन को हैलोजन परमाणु से जुड़े कार्बन परमाणु के आधार पर इन्हे तीन भागों में बांटा गया है:
(a) प्राथमिक ऐल्किल हैलाइड:- इनमें हैलोजन परमाणु प्राथमिक C कार्बन परमाणु से जुड़ा होता है। इन्हे R-CH2-X से प्रदर्शित करते हैं।
(b) द्वितीयक ऐल्किल हैलाइड:- इनमे हैलोजन परमाणु द्वितीयक C(20) कार्बन परमाणु से जुड़ा होता है। इन्हें R2 CH-X से प्रदर्शित करते हैं।

(c) तृतीयक ऐल्किल हैलाइड:- इनमें हैलोजन परमाणु तृतीयक C(30) परमाणु से जुड़ा होता है इन्हे R3 C-X से प्रदर्शित करते हैं।

(3) ऐलिलिक हैलाइड (Allylic Halide):- इन मोनो हैलाइड मे हैलोजन परमाणु sp3 संकरित c परमाणु से जुड़ा होता है, यह Sp3 संकरित c परमाणु sp2 संकरित c परमाणु से जुड़ा होता है तो इन मोनो हैलाइड को ऐलिलिक मोनो हैलाइड कहते हैं।
इनमे CH= CH-CH2-X समूह उपस्थित होता है।
(4) बेल्जिलिक हैलाइड (Benzylic Halide):- इन मोनोहैलाइड मे sp3 संकरित C-X बेन्ज़ीन वलय से जुड़ा होता है तो इन्हे बेनिजलिक हैलाइड कहते है।
(5) ऐरिल हैलाइड (Aryl Halide):- यह मोनो हैलाइड में हैलोजन परमाणु बेन्जीन वलय के C परमाणु से जुड़ा होता है। तो इन्हे ऐरिल हैलाइड कहते है।
(6) वाइनिलिक हैलाइड (Vinylic Halide):- इन मोनो हैलाइड में हैलोजन परमाणु ऐलिफेटिक हाइड्रोकार्बन में उपस्थित द्विबन्धित C (C=C-X) से जुड़ा होता है तो इन्हें Vinylic Halide कहते है।
मोनो हैलोऐल्केन का नामकरण:- इन यौगिकों का साधरण नाम एल्किल हैलाइड से देते है।
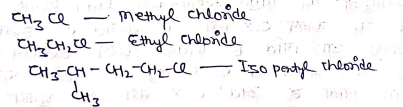
इन यौगिकों का IUPAC में नाम, No हैलोएल्केन से देते है
हैलोएल्केन में C-X बन्ध की प्रकृति :-
हैलोएल्केनो में हैलोजन परमाणु एकल बन्धित कार्बन परमाणु से जुड़ा होता है जिस पर संकरण अवस्था sp3 पाई जाती है।
जैसे – CH3CL में Sp3 संकरित कार्बन परमाणु का एक Sp3 संकरित कक्षक क्लोरीन परमाणु के 3Px अर्धपूर्ण कक्षक से अतिव्यापन कर (Sp3 – p) C-Cl एकल बन्ध बनाता है|
विभिन्न C-X के मध्य बंध लम्बाई एवं बन्ध ऊर्जाये निम्न है।
| बंध लम्बाई | बन्ध ऊर्जा | |
|---|---|---|
| C-F | 139 | 452 |
| C-Cl | 170 | 351 |
| C-Br | 193 | 293 |
| C-I | 214 | 234 |
विभिन्न हैलोजनो के मध्य बन्ध प्रबलता क्रम में है:- C-F> C-Cl> C-Br> C-I
हैलोजन परमाणुओ की विद्युत ऋणात्मकता कार्बन परमाणु से अधिक होने के कारण C-X बन्ध के बन्धित e– हैलोजन तत्व की तरफ आ जाते हैं जिसके कारण हैलोजन तत्व पर आंशिक ऋण आवेश व C परमाणु पर आंशिक धन आवेश बन जाता है अत: C-X बंध एक ध्रुवीय सहसंयोजक बन्ध की तरह व्यवहार करता है।

- C – X बन्ध के ध्रुवीय प्रवृत्ति होने के कारण ही एल्किल हैलाइड द्विध्रुव आघूर्ण प्रदर्शित करता है ।
- विभिन्न एल्किल हैलाइड का द्विध्रुव आघूर्ण निम्न है – CH3F> CH3Cl>CH3Br> CH3I
- C-X ध्रुवीय बन्ध होने के कारण ऐल्किल हैलाइड नाभिक स्नेही प्रतिस्थापी अभिक्रियाएं देते है।
निर्माण की सामान्य विधियां:-
(1) ऐल्कोहॉलो से:-
ऐल्कोहॉलो में – OH समूह को, हैलोजन परमाणु द्वारा प्रतिस्थापित करने से ऐल्किल हैलाइड प्राप्त किये जा सकते है। यह अभिक्रिया निम्नलिखित अभिकर्मको द्वारा सम्पन्न कराई जाती है।
(a) हैलोजन अम्लो की क्रिया से:-
हाइड्रोजन क्लोराइड गैस को निर्जल जिंक क्लोराइड की उपस्थिति में किसी एल्कोहॉल मे प्रवाहित करने से ऐल्किल क्लोराइड प्राप्त होता है।

- हाइड्रोब्रोमिक अम्ल को NaBr+ सान्द्र H2SO4 की थोड़ी मात्रा की उपस्थिति में एल्कोहॉलो के साथ गर्म करने पर ऐल्किल ब्रोमाइड प्राप्त होता है।
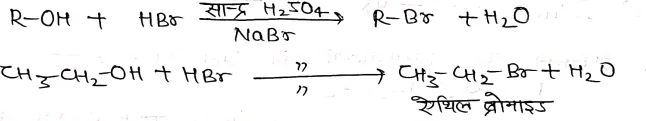
- इसी प्रकार एल्किल आयोडाइड प्राप्त करने के लिए हाइड्रो आयोडिक अम्ल को एल्कोहॉल से क्रिया करके बनाया जाता है।

Note- विभिन्न हैलोजन अम्लो की क्रियाशीलता का क्रम – HI> HBO> HCl
(b) फास्फोरस हैलाइडो से क्रिया : –
- ROH + PCl5 → RCl + POCl3 +HCl
- 3ROH +PCl3 → 3RCl +H3PO3
फॉस्फोरस ट्राई ब्रोमाइड तथा ट्राई आयोडाइड द्वारा उपरोक्त प्रकार की रासायनिक अभिक्रिया कराते समय इन्हे फलस्क में बनाते है। इसके लिए ब्रोमीन या आयोडीन को लाल फॉस्फोरस और एल्कोहॉल के मिश्रण से मिलाते है।
P4 + 6Br2 → 4Br3
3C2H5OH + PBr3 -> 3C2H5Br + H3PO3
(2) ऐल्केन के हैलोजनीकरण द्वारा –
किसी ऐल्केन की क्लोरीन अथवा ब्रोमीन के साथ सूर्य के प्रकाश की उपस्थिति अथवा उच्च ताप पर अभिक्रिया कराने पर क्रमश: ऐल्किल क्लोराइड या ब्रोमाइड प्राप्त होता है।
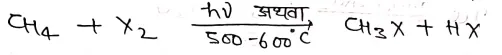
उपर्युक्त अभिक्रिया मोनो हैलोजनीकरण पर ही नही रुकती अपितु इसके फलस्वरूप डाई, ट्राई तथा टेट्राहैलो व्युत्पन्न भी बनते है।

Note:- हैलोजन की क्रियाशीलता का क्रम निम्न है:- F2>Cl2> Br2>I2

(3) ऐल्कीन से:-
ऐल्कीन की हाइड्रोजन हैलाइड (HX) के साथ योगात्मक अभिक्रिया द्वारा एल्किल हैलाइड बनता है। असममित ऐल्कीन पर योग मार्कोनीकाफ के नियम के अनुसार होता है। परन्तु परॉक्साइड की उपस्थिति में केवल HBr को योग मार्केनीकाफ नियम के विपरीत होता है।

(4) मोनो कार्बोकिसलिक अम्लो से :-
हुन्सडीकर अभिक्रिया:- जब हम RCOOAg की क्रिया Br2 से कराई जाती है तो इसे हुन्सडीकर अभिक्रिया कहते है। यह क्रिया सामान्य ताप पर होती है।

- यह विधि RBr बनाने की सर्वोत्तम है क्योंकि इसमे RBr की प्राप्ति 60-90% होती है।
- इस विधि से RCl भी बनाया जा सकता है परन्तु RI नहीं ।
- सामान्यतः ऐल्किल ब्रोमाइड (RBr) इस विधि द्वारा बनाये जाते है। ऐल्किल क्लोराइड की लब्धि कम आती है।
- आयोडीन की अभिक्रिया में एस्टर मुख्य उत्पादन के रूप में होता है।

(5) हैलाइड विनियम द्वारा:-
यह विधि विशेष रूप से ऐल्किल आयोडाइड तथा एल्किल फ्लोराइड बनाने के लिए प्रयुक्त होती है।
ऐल्किल क्लोराइड अथवा ब्रोमाइड के ऐसीटोन विलयन मे पोटैशियम आयोडाइड का ऐसीटोन विलयन मिलाने पर एल्किलआयोडाइड बनता है। यह फ्रिकल्स्टाइ (Finkelstein) अभिक्रिया कहलाती है।

एल्किल फ्लोराइड के विरचन के लिए एल्किल क्लोराइड की अभिक्रिया धातु फ्लोराइड जैसे – मर्क्यूरस फ्लुओराइड के साथ कराई जाती है। इस अभिक्रिया को स्वार्ट अभिक्रिया कहते है।
2RCl + Hg2F2–>2RF + Hg2Cl2
(6) प्राथमिक ऐमीन से:-
प्राथमिक ऐमीन की नाइट्रोसील क्लोराइड (टिल्डन अभिकर्मक) से क्रिया कराने पर ऐल्किल क्लोराइड बनता है।
RNH2+ NOCl -> R-Cl + N2+ H2O
गुणधर्म
भौतिक गुण :-
(a) कमरे के ताप पर CH3F, CH3Cl, CH3Br, C2H5F, C2H5Cl सभी गैस है। इसके बाद वाले [C15H31X तक] मधुर गंध वाले द्रव है। इसके ऊपर वाले रंगहीन लोस है।
(b) ऐल्किल हैलाइन के घनत्व अणुभार के समानुपाती होते है। अनुसार अधिक होने पर घनत्व अधिक होते हैं ।
- CH3I> CH3Br > CH3Cl > CH3F
- CH3Cl > C2H5Cl > C3H7Cl > C4H9Cl > C5H11Cl
(c) एल्किल आयोडाइड एवं एल्किल ब्रोगाइड जल से भारी होते है तथा जल के नीचे सतह बना लेते हैं। ऐल्किल क्लोराइड तथा ऐल्किल फ्लुओराइड जल से हल्के होते है तथा जल पर तैरते है।
(c) हैलो ऐल्केनो के गलनांक तथा क्वथनांक जनक ऐल्केनो अधिक होते है।
हैलो ऐल्केनो का क्वथनांक अणुभार के बढ़ने पर बढ़ता है।

- हैलो ऐल्केनो का अणुभार समान होने पर –

अतः शाखन के बढ़ने पर क्वथनांक घटता है।
समावयवी हैलोऐल्केनो में क्वथनांक निम्न क्रम में होते हैं:- प्राथमिक हैलोऐल्केन > द्वितीय हैलोऐल्केन > तृतीयक हैलोऐल्केन

(d) हैलोऐल्केन जल में अविलेय होते है लेकिन कार्बनिक विलायको जैसे ईथर, एल्कोहॉल आदि में शीघ्र विलेय है।
रासायनिक गुण :
- (a) ऐल्किल हैलाइड अत्यधिक सक्रिय यौगिक होते है। कारण इन यौगिकों में ध्रुवीय C-X आबन्ध उपस्थित होने के कारण ।
- (b) विभिन्न हैलाइडो की क्रियाशीलता बन्ध ऊर्जा के व्युत्क्रमानुपाती होती है।

I का आकार अत्यधिक बड़ा होने के कारण इसकी C-I बन्ध ऊर्जा का मान सबसे कम होगा अतः C-I यौगिक अधिक क्रियाशील होता है।
- C-F>C-Cl>C-Br> C-I (बन्ध ऊर्जा का क्रम)
- R-I> R-Br> R-Cl> R-F (क्रियाशीलता का क्रम)
- C-F बंध की उच्चतम ऊर्जा होने के कारण फ्लुओरोस्स्केन सबसे कम क्रियाशील होते हैं।
- c-x बन्ध की ध्रुवता के कारण हैलोऐल्केन नाभिकस्नेही अभिक्रियाओं व विहाइड्रो हैलोजनीकरण अभिक्रियाएं देते है|।
(1) नाभिकस्नेही अभिक्रियाएं
ऐल्किल हैलाइड में उपस्थित C-X बन्ध की ध्रुवीय प्रकृति के कारण कार्बन पर आंशिक घन आवेश व X परमाणु पर आंशिक ऋणआवेश आ जाता है।
ये अभिक्रियाएं दो प्रकार की होती है –
- (a) SN1 (एक आण्विक प्रतिस्थापन अभिक्रिया)
- (b) SN2(द्वि आण्विक प्रतिस्थापन अभिक्रिया)
(a) SN1 अभिक्रिया
- यह अभिक्रिया दो पदो में पूर्ण होती है।
- इसका प्रथम पद अभिक्रिया का वेग निर्धारक पद होता है।
- इसके प्रथम पद में ऐल्फिल हैलाइड का एक अणु ही क्रिया में भाग लेता है। अर्थात इस अभिक्रिया की दर ऐल्किल हैलाइड की सान्द्रता पर निर्भर करती हैं। नाभिक स्नेही की सान्द्रता पर निर्भर नहीं करती। वेग = K[RX]
- इसीलिए यह प्रथम कोटि की अभिक्रिया है।
प्रथम पद:- इस पद में एल्किल हैलाइड का अणु आयनीकृत होकर कार्बोधिनायन [Carbocation] बनाता है।

- प्रथम पद में प्राप्त मध्यवर्ती कार्बोधिनायन के स्थायित्व पर विभिन्न ऐल्फिल हैलाइडो की क्रियाशीलता निर्भर करती है।
- विभिन्न तृतीय कार्बधनायन के स्थायित्व का क्रम निम्न है – तृतीय C+> द्वितीयक C+ > प्राथमिक C+> CH3+
अतः तृतीयक एल्किल हैलाइड कर मे SN1 क्रियाविधि की पाये जाने की अधिक संभावना होगी।
द्वितीय पद:- इस पद में, प्रथम पद से प्राप्त फ्रियाशील कार्बधनायन नाभिकस्नेही / नाभिकरागी के साथ तीव्र गति से क्रिया कर प्रतिस्थापी उत्पाद बनाता है

(b) द्विअणुक नाभिकरागी प्रतिस्थापन अभिक्रिया (SN2)
यह अभिक्रिया प्राथमिक R-x द्वारा की जाती है।इसमें नाभिकरात्री का पक्ष आक्रमण होता है तथा संक्रमण अवस्था बनती है ।

SN1 व SN2 अभिक्रिया में अंतर –
| SN1 | SN2 |
|---|---|
| अभिक्रिया की कोटि =एक | अभिक्रिया की कोटि =2 |
| इसमें कार्बोकेटायन बनता है। | इसमें संक्रमण अवस्था प्राप्त होती है। |
| यह क्रिया ध्रुवीय विलापको की उपस्थिति में होती है। | यह अध्रुवीय विलायको की उपस्थिति में होती है। |
| एल्किल हैलाइड क्रियाशीलता का क्रम – R-X>Sec R-X> IoRX>CH3X | CH3X>IoRX >2oRX>3RX |
(2)वुर्टज अभिक्रिया:-
जब किसी R-X की सोडियम के साथ ईथरीय विलयन में क्रिया कराते है, तब हाइड्रोकार्बन का उच्च सदस्य प्राप्त होता है, यह अभिक्रिया वुर्टज अभिक्रिया कहलाती है।

(3) ग्रिगनाई अभिकर्मक का निर्माण:-
हैलोऐल्केन mg से शुष्क ईथर की उपस्थिति में क्रिया करके एल्किल मैग्नीशियम हैलाइड बनाता है। जिसे ग्रिगनाई अभिकर्मक कहते है।

R-mg -X की सभी क्रियाओ में बंध R तथा mg के बीच टूटेगा।
(4) फ्रैकलैण्ड अभिक्रिया
एथिल ब्रोमाइड की अभिक्रिया एक बंद नली में Zn से कराने पर डाई एथिल जिंक का निर्माण होता है। यह अभिक्रिया फ्रैकलैण्ड अभिक्रिया कहलाती है।

(5) विलियम्सन ईथर संश्लेषण
एल्कोहॉल, R-X और क्षार की क्रिया कराने पर ईथर का निर्माण होता है। यह क्रिया विलियम्सन ईथर संश्लेषण कहलाती है।

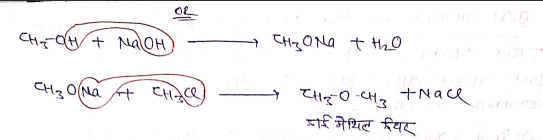
(6) अपचयन:-
नवजात हाइड्रोजन द्वारा अपचयित कराने पर यह ऐथेन में परिवर्तित हो जाता है। इस अभिक्रिया में प्रयुक्त नवजात (H) को Zn-Cu युग्म तथा एकोहॉल, Al-Hg अम्लगम तथा एल्कोहॉल, Na -Hg अम्लगम तथा जल आदि की क्रिया से बनाया जाता है ।

(7) NaCN या KCN से क्रिया –

(8) पोटैशियम या सोडियम नाइट्राइट से क्रिया –

(9) सिल्वर नाइट्राइड से क्रिया –
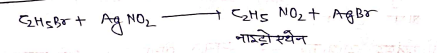
(10) लीथियम डाइऐल्किलफ्यूप्रेट से क्रिया-

इस अभिक्रिया को कोरे हाउस ऐल्केन संश्लेषन कहते हैं।
डाई हैलोजन व्युत्पन्न
किसी ऐल्केन के दो हाइड्रोजन परमाणु हैलोजन परमाणुओं द्वारा प्रतिस्थापित कर दिए जाने पर प्राप्त यौगिक डाइहैलोजन व्युत्पन्न कहलाता है। दोनो हैलोजन परमाणुओ क़ी पारस्परिक स्थिति के आधार पर तीन भागों में बांटा गया है-
(i) जैम डाईहैलाइड:- दोनो हैलोजन परमाणु एक ही कार्बन पर जुड़े हो तो इसे जैमडाई हैलाइड कहते हैं।
उदा०-

(ii) विस डाईहैलाइड:- इनमें हैलोजन परमाणु निकटवर्ती दो कार्बन परमाणुओं से जुड़े होते है।
उदा०

(iii) α,ω डाईहैलाइड:- कार्बन श्रृंखला के प्रथम एवं अन्तिम कार्बनपरमाणु पर हैलोजन परमाणु जुड़ा हो, तो इन्हें α,ω डाईहैलाइड कहते है।
उदा०

डाई हैलोजन व्युत्पन्न के रासायनिक गुण –
(1) विहाइड्रो हैलोजनीकरण:- ऐल्कोहॉली KOH से अभिक्रिया करके संगत ऐल्काइन का निर्माण करते है।
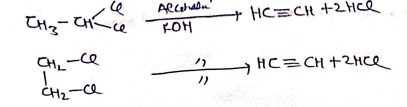
(2) विहैलोजनीकरण:-

डाई हैलोजन व्युत्पन्न का उपयोग –
- रबर के लिए विलायक के रूप में।
ट्राई हैलोजन व्युत्पन्न :-
ट्राई हैलोजन व्युत्पन्नो में क्लोरोफार्म (CHCl3) एवं आयोडोफार्म (CHI3) दो महत्वपूर्ण यौगिक है जिन्हें हैलोफार्म भी कहते है तथा इन्हे हैलोफार्म अभिक्रिया के द्वारा बनाया जाता है
(1) क्लोरोफार्म (CHCl3)
(i) शुद्ध क्लोरोफार्म, क्लोरल को NaOH के विलयन के साथ गर्म करने पर प्राप्त होती है।

(ii) हैलोफार्म अभिक्रिया – इस अभिक्रिया में एल्कोहॉल , ऐल्डिहाइड, एवं ऐसीटोन विलयन को Cl2 तथा क्षार के साथ गर्म करने पर हैलोफार्म बनता है, इसे हैलोफार्म अभिक्रिया कहते है।

(iii) सोडियम हाइपो क्लोराइट (NaOCl) से:- सोडियम हाइपोक्लोराइट विलयन हैलोफार्म अभिक्रिया द्वारा निम्न प्रकार से क्लोरोफार्म बनता है।
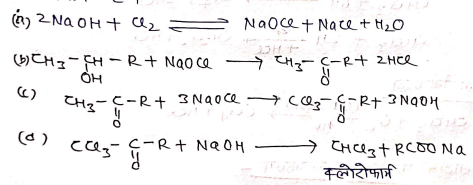
(iv) कार्बन ट्रेटा क्लोराइड से –

(v) CH4 के क्लोरीनिकरण से –

क्लोरोफार्म के भौतिक गुण :-
- (I) CHCl4 भारी, रंगहीन, मीठी गन्ध वाला द्रव्य है।
- (II) इसे सूघने पर बेहोशी या मूर्च्छा आ जाती है
- (III) इसका क्वथनांक 334K होता है।
- क्लोरोफार्म की शुद्धता का परीक्षण:- शुद्ध क्लोरोफार्म AgNO3 विलयन के साथ श्वेत अवक्षेप नहीं देता है। जबकि अशुद्ध क्लोरोफार्म शवेत अवक्षेप देता है,क्योंकि

अशुद्ध क्लोरोफार्म में वायु एवं प्रकाश की उपस्थिति के कारण बनी HCl गैस उपस्थित होती है जो AgCl का अवक्षेप देती है।
रासायनिक गुण –
(1) अपचयन

(II) क्लोरीनीकरण –

(III) ऐसीटोन के साथ अभिक्रिया-

(IV) जल अपघटन

(V) कार्बिलऐमीन अभिक्रिया –

(VI) राइमर टीमन अभिक्रिया –

(VII) रजत पाउडर से-

उपयोग :
- इसका उपयोग प्राय: वसा, ऐल्केलाइड तथा आयोडीन अन्य पदार्थो के विलायक के रूप में।
- वर्तमान में क्लोरोफार्म का प्रमुख उपयोग फ्रेआन प्रशीतक बनाने में होता है।
- इसको सूंघने से केन्द्रीय तंत्रिका तंत्र अवनमित हो जाता है।
- क्लोरोफार्म प्रकाश की उपस्थिति में वायु द्वारा धीरे-धीरे ऑक्सीकृत होकर विषैली गैस कार्बोनिल क्लोराइड बनाती है जिसे फास्जीन भी कहते हैं |
- (V) भंडारण के लिए इसे पूर्णतः भरी हुई रंगीन बोतल में रखा जाता है ताकि उनमें वावायुबु न रहें।
आयोडोफार्म
बनाने की विधि
हैलोफार्म अभिक्रिया द्वारा –

भौतिक गुण
- आयोडोफार्म पीले रंग का ठोस है। यह जल में अविलेय लेकिन एल्कोहॉल, ईथर, CHCl3 इत्यादि में विलेय हो जाता है।
- इसका गलनांक 392K होता है
रासायनिक गुण:- आयोडोफार्म की अधिकांश अभिक्रियाएं क्लोरोफार्म के समान होती है।

उपयोग :-
आयोडोफार्म रोगाणुनाशक के रूप में कार्य करता है।
कार्बन ट्रेटा क्लोराइड
उपयोग → आग बुझाने में।
बनाने की विधियों :-
(i) मेथेन से –

(ii) कार्बनडाई सल्फाइड से –
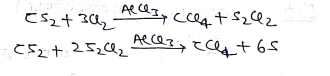
(iii) प्रोपेन से –

(iv) क्लोरोफार्म के क्लोरीनीकरण से –
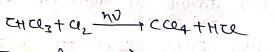
भौतिक गुण :-
- रंगहीन, मधुर गंधयुक्त वाष्पशील द्रव होता है।
- जल में अविलेय परंतु एल्कोहाल, ईथर में विलेय
- अज्वलनशील द्रव
- व्यापारिक नाम =पायरीन
रासायनिक गुण –
(1) भाप से क्रिया-

(11) राइमन टीमन अभिक्रिया –

हैलो ऐरीन [Haloarenes]
इन यौगिकों में हैलोजन परमाणु ऐरोमैटिक वलय के कार्बन से सीधा जुड़ा होता है। इसे Ar-X से दर्शाते है

IUPAC पद्धति में इनका नामकरण करने के लिए इन यौगिको को बेंजीन का व्युत्पन्न मानते हुए हैलोजन का पूर्व लग्न काम में लेते है एवं नाम लिखा जाता है।
उदा०→

हैलोएरिन या ऐरिल हैलाइड में C-x बंध की प्रकृति –
ऐरिल हैलाइड जैसे C6H5Cl में क्लोरीन परमाणु बेंजीन वलय के Sp2 संकरित C से जुड़ा होता है। हैलोजन परमाणु के अनुनाद प्रभाव (+R) के कारण कार्बन हैलोजन बंध मे आंशिक द्विबन्ध का गुण आ जाता है अत: यह बन्ध आसानी से नहीं टूटता ।
क्लोरो बेंजीन में C-Cl बन्च की लम्बाई 106oA में है जबकि C-Cl एकल बंध की लम्बाई 1-77oA में होती है ।
बंध लम्बाई के मान में आयी कमी C-Cl बन्ध में आंशिक द्विबन्ध की पुष्टि करता है।
क्लोरो बेजीन की अनुवादी संरचना निम्न है –

हैंलोऐरीनो के बनाने की विधियां:-
(1) बेंजीन के हैलोजनीकरण द्वारा –
- इनमें बेंजीन का क्लोरीनीकरण एवं ब्रोमीनीकरण सीधे Cl2 व Br2 द्वारा लुईस अम्ल की उपस्थिति (AlCl3, sbCl3, FeCl3) करते हैं।

क्रियाविधि:- बेंजीन में क्लोरीनीकरण की क्रियाविधि निम्न प्रकार दिखाते है। यह बेंजीन की इलेक्ट्रॉन स्नेही प्रतिस्थापन अभिक्रिया देती है
(1) इलेक्ट्रॉन स्नेही का निर्माण –

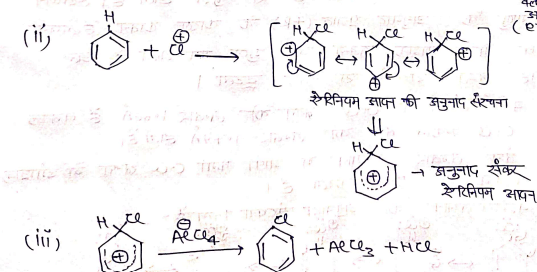
पार्श्व श्रृंखला में हैलोजीनीकरण :-
जब टालूईन की Cl2 के साथ, प्रकाश की उपस्थिति एवं लुईल अम्ल की अनुपस्थिति में क्रिया कराने पर, हैलोजीनीकरण की क्रिया पार्श्व श्रृंखला पर होती है।

यदि Cl2 गैस को अधिक मात्रा में प्रवाहित करने पर पार्श्व श्रृंखला के अन्य हाइड्रोजन परमाणु भी Cl के द्वारा बेंजल क्लोराइड व बेंजोक्लोराइड बनाते है।

(2) प्रयोगशाला विधि:-
प्रयोगशाला में क्लोरोबेंजीन को बनाने के लिए ऐनिलीन को 0°C से 5°C ताप पर NaNO2 तथा HCl के मिश्रण को क्रिया कराने पर बेंजीन डाइरेजोनियम क्लोराइड प्राप्त होता है।

प्राप्त बेंजीन गईऐजोनियम क्लोराइड को क्यूप्रेस क्लोराइड तथा HCl अम्ल की उपस्थिति में क्रिया कराने पर क्लोरो बेंजीन प्राप्त होता है। जिसे सेन्डमेयर अभिक्रिया भी कहते हैं।

(3) हुन्सडीकर अभिक्रिया से –

(4) PCl5 से क्रिया कराने पर –

(5) औद्योगिक विधि:-
बेंजीन, वाष्प, HCl गैस तथा ऑक्सीजन के मिश्रण को CuCl2 उत्प्रेरक पर 250oC पर प्रवाहित करने से क्लोरोबेंजीन प्राप्त होता है। इस विधि को राशिग विधि (Rasching Method) भी कहते हैं।

भौतिक गुण :-
- यह रंगहीन, वाष्पशील तथा सुगन्धित द्रव है।
- इसका क्वथनांक 132°C है।
- ये जल से भारी होते हैं। इनके घनत्व निम्न क्रम में है -आयोडोबेजीन > ब्रोमोबेजीन> क्लोरोबेजीन> फ्लुओरोबेजीन
इनके क्वथनांक का क्रम निम्न है –

ये जल में अविलय लेकिन कार्बनिक विलायको में विलेय है।
हैलोऐरीनो के रासायनिक गुण –

(1) नाभिक रागी प्रतिस्थापन अभिक्रिया

(2) इलेक्ट्रानराजी अभिक्रियाएं :-
(i) हैलोजनीकरण –

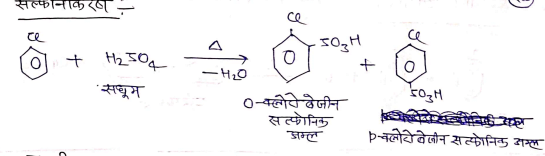
(ii) सल्फोनीकरण –
(iii) नाइट्रीकरण
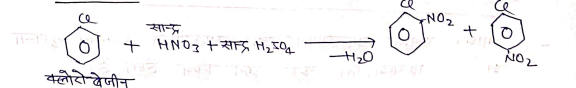
(iv) फ्रीडल क्राफ्ट अभिक्रिया –

(3) मैग्नीशियम (Mg) से क्रिया :-

(4) फिटिंग अभिक्रिया –

(5) वुर्ट्ज फिटिग अभिक्रिया
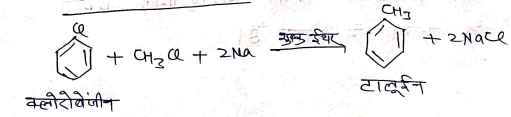
(6) उलमान अभिक्रिया

हैलोजन व्युत्पन्नों में क्रियाशीलता का क्रम –
नाभिक स्नेही प्रतिस्थापन के प्रतिमोनो हैलोजन व्युत्पन्नो में क्रियाशीलता का क्रम निम्न होता है।

(7) क्लोरल से अभिक्रिया :-
सान्द्र H2S04 की उपस्थिति में क्लोरोबेजीन को क्लोरल के साथ गर्म करने पर D,p1 डाई क्लोरो डाई फेनिल- ट्राईक्लोरोऐथेन बनता है जिसे संक्षेप में D.D.T कहते है। यह एक प्रबल तथा प्रमुख कीटाणुनाशक है।

उपयोग:- हैलोऐरीनो का उपयोग ऐनिलीन, फीनाल, क्लोरोनाइट्रो बेंजीन तथा कीटाणुनाशक DDT के निर्माण में होता है।
फ्रिऑन (Fron): –
CH4 व C2H6 के क्लोरोफ़्लोरो व्युत्पन्न को फ्रिऑन कहते है।
फ्रिऑन का निर्माण:- मेथेन एवं ऐथेन के क्लोरोफ्लोरो वयुत्पन्न CCl4– या C2Cl6 की SbCl5 की उपस्थिति में HF से क्रिया करके प्राप्त किए जाते हैं,

उपयोग:-
- फ्रिआन 1,2 (CF3Cl2)उद्योगों में सर्वाधिक प्रयुक्त होने वाले सामान्य फ्रेआनो में से एक है।
- अक्रिय विलायक के रूप में l
- यह ऐरोसॉल, प्रणोदक, प्रशीतक तथा वायु शीतलन में उपयोग की जाती है।
- नुकसान –> फ्रिआन मुख्यत ओजोन परत का हास करती है
BHC [ बेंजीन हेक्सा क्लोराइड]
- इसके अनेक व्यापारिक नाम है- जैसे – गैमेक्सेन, लिण्डेन, 666 आदि ।
- इसका IUPAC नाम 1,2,3,4,5,6 हेक्साक्लोरो सारक्लो हेक्सेन है।
- यह पराबैगनी प्रकाश की उपस्थिति में बेंजीन की क्लोरीन की अभिक्रिया से प्राप्त होता है।
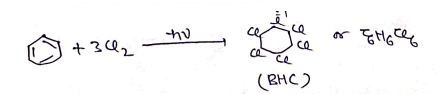
• इसका उपयोग कृषि क्षेत्र में कीटनाशी के रूप में किया जाता है |

Comments
Post a Comment